- 30% af Calcium tallet ved kogning og
- 60% af dit bikarbonat tal.
Vandbehandling kogt vand.
Når vand koges, så udfældes der kalksten på varmelegmet det ved alle der har hårdt vand. Bikarbonaten udfældes sammen med Calcium, til et tungt opløsligt salt.
Dette kan udnyttes til at lave lidt blødere vand Bikarbonaten bundfældes og det blødere kolde vand kan suges over i en anden beholder med en hævert. Det er vigtigt at vandet er koldt og det skal stå mindst 6 timer. Her er der hvad der sker:
Ca ++ binder sig til 2 stk HCO3-
Vi ved desværre ikke direkte, hvor meget Calcium / Bikarbonat der bundfældes da der jo er andre opløste salte i vandet. Har vi derimod tallet på den temporære / forbigående hårdhed så er vi kørende ! Den forbigående hårdhed er netop tallet for hvor meget der udfældes ved kogning.
Vandværk: |
Total hårdhed: |
Forbigående hårdhed: |
|
Hou |
22,3 |
13,8 |
|
Københoved |
14,0 |
10,8 |
|
Holsted |
10,0 |
5,2 |
|
Mejlby |
13,6 |
3,5 |
|
Taulow |
14,2 |
3,6 |
|
Kirke Eskildstrup |
18,6 |
15,4 |
Et lille udpluk af vandværker, fra blødt til hårdt vand, viser tydeligt at den forbigående hårdhed svinger fra 25% til 75% - så der kan ikke generaliseres her. (Selvom der påståes andet på nettet)
For at vide helt præcis hvad der sker under kogningen, så en du nødt til at kende din total hårdhed og din forbigående hårdhed. Desværre har moderne vandanalyserapporten kun totalhårdheden. Kan du støve en 15 18 år gammel rapport frem, så er der chance for at begge tal er der.
Hvis din forbigående hårdhed er 60% af din totale hårdhed, så vil kogning fjerne 60% af din bikarbonat.
Bestemmelse af forbigående
hårdhed
Jeg er ikke kemikker og har lidt svært med alle disse sjove begreber, men 1 hårdhedsgrad også beskrevet som ° dH eller tyske hårdhedsgrad er blot en måde at fortælle hvor meget kalk der er i vandet.
1 ° dH er standard defineret ved 0,010 g CaO per liter = 10 mg / L
Da vores hårde vand ikke består af CaO, så må vi konvertere til et andet format. (ligesom tommer og cm) Man kan slå op at molar massen af Calsium er 40 og ilt O ( = Oxygen) er 16. Det vil sige at CaO tilsammen har massen 40 + 16 = 56 [g/mol] Læs mere om Stofmængde her.
Vi har nu 1 ° dH = 10 mg / L altså 10 mg forårsaget af et stof der vejer 56 g/mol. Hvis vi så gerne vil vide hvad koncentrationen er, så dividere vi blot de 10 mg med den såkaldte molar masse:
0,010 (g/L) / 56 (g/mol) = 0,000178 M
Altså svare 1 °dH til en koncentration på 0,000178 M
Envidere binder Ca ++ jo O - - i forholdet 1 til 1 ( de har samme såkaldte ækvivalenser), så vi kan udlede at Ca ++ koncentration også er på 0,000178 M.
Når vi ser på vores forbigående hårdhed bestående af bikarbonat i forbindelse med mest Calcium og en smule Magnesium så binde Ca ++ jo 2 stk HCO3- hver gang der udfældes 1 Calcium. Vi kan også sige det den anden vej, hver gang vi udfælder 1 stk HCO3- ion, så ryger der kun den ½ mængde Ca.
Hvis vi ved hvor meget forbigående HCO3- vi har fra vandrapporten, (Data for den forbigående hårdhed) , så er det ret nemt at regne den anden vej og vi ved hvor meget bikarbonat der forsvinder ved kogning.
Er den forbigående hårdhed 60% af total hårdheden så ryger der kun
Titrering af HCO3-
Desværre er det ikke alle vandrapporter der opgiver forbigående hårdhed, så undertegnet må selv prøve at måle den.
HCO3- kan nemt måles op imod en kendt syre. Hvis man langsomt tilsætte lidt syre til vand med HCO3- så vil pH falde. Netop ved pH = 4,00 er der ikke flere frie ioner (det er noget man kan se i et såkaldt Bjerrum diagram) og man kan nu aflæse den brugte mængde syre og udregne hvor meget HCO3- der er forsvundet fra vandet.
Saltsyre HCl + HCO3-
bliver til H2CO3
+ Cl- 
Forholdet mellem HCl og HCO3 er jo 1 til 1, så når vi kender den brugte syremængde så kender vi således også HCO3 mængden.
Opsumering: Saltsyren HCl hænger sammen med HCO3 i forholdet 1 til 1. Vores HCO3 mængde er ukendt, men vi kender mængden og koncentrationen af syren. Ved pH = 4,0 så er der tilsat så meget syre at alt HCO3 netop er omsat. Nu kan tallene fra syre tilsætningen bruges til at udregne mængden af HCO3
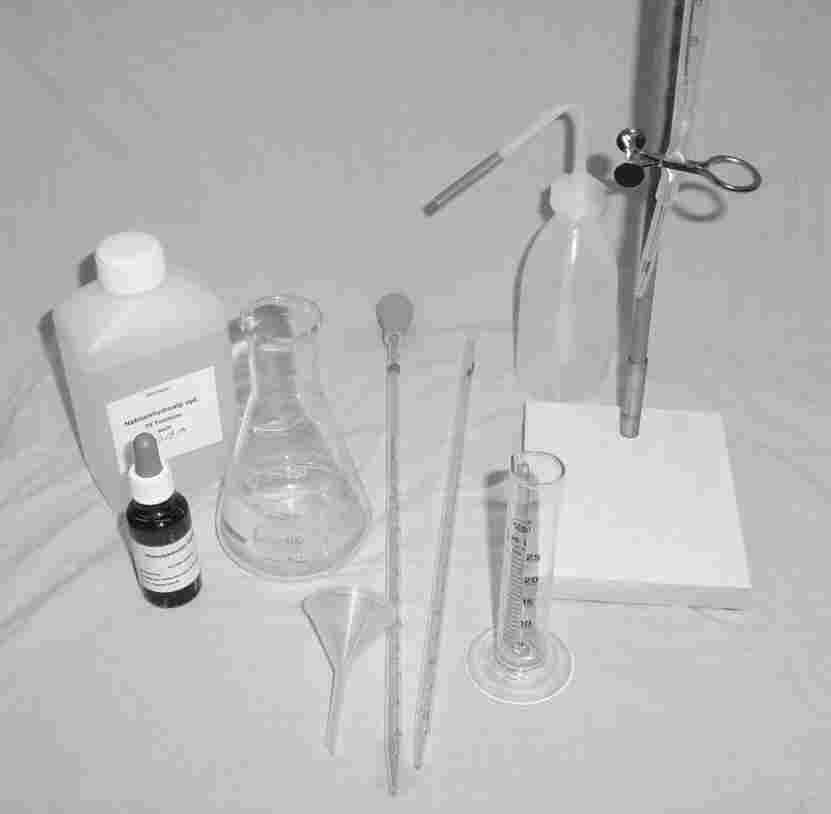
Titreringen her kræver: Et målebærer til afmåling af 100 ml vand, et åbent bæger til vandet, en titrerings kollone med klem hane, en lille tragt, en flaske 0,100 M saltsyre og et pH meter til aflæsning af pH = 4,0. (pH meteret kan dog erstattes af Methylorange indikator der har farveskifte ved netop pH 4,0)
Der måles på 100 ml vand, og der titreres (tilsættes) 0,100 M saltsyre (HCl) Jeg fik et seriøst drop til under pH 4,0 ved 5,5 mL syre:
Stof mængden af (HCO3-) = Konsentrationen af syren x forbrugt volume.
Stof mængden af (HCO3-) = 0,100 x 0,0055 L = 0,00055 mol
Koncentrationen af syren er så den samme som koncentrationen af HCO3 men i 100 ml vand.
[HCO3-] = Stof mængden af (HCO3-) / 0,100 L
[HCO3-] = 0,00055 / 0,100 L = 0,0055
Vi ved jo at Calcium binder 2 stk HCO3- derfor er antallet af udfældet Ca jo kun det halve af 0,0055
Koncentrationen af Ca++ = 0,0055 / 2 = 0,00275 M
Forbigående Hårdhed = [ Ca++] / Koncentrationen af 1 °dH og i tal bliver det 0,00275 / 0,000178 M
Forbigående Hårdhed = 15,4 °dH.
Kirke Eskildstrup vandværk har en total hårdhed på 18,6 °dH og den forbigående hårdhed har vi udregnet til 15,4 °dH. Calcium = 120 mg & Bicarbonat = 314 mg
Kogt vand har derfor en hårdhed på: 18,6 15,4 = 3,2 °dH. Ganske blødt !! Hårdheden er reduceret med 15,4 / 18,6 = 0,83 eller 83 %
Det nye Calcium tal bliver reduceret med ½ x 83% = 41,5% eller der er 58,5% tilbage af det oprindelige tal. Nyt Calcium tal = 120 x 0,585 = 70,2 mg / L
Det nye bikarbonat tal bliver reduceret med fulde 83% eller der er 17 % tilbage af det oprindelige tal. Nyt bikarbonat tal = 314 x 0,17 = 53 mg / L
Tallene kan nu puttes ind i Palmers skema, for at se effekten af kogningen !!! Regneark til udregning af dine tal:
